原子結(jié)構(gòu)是指原子中電子在不同能級和軌道上的分布和排列方式。在描述原子結(jié)構(gòu)之前,先來了解一下原子的基本組成。原子由原子核和繞核運動的電子組成,原子核由質(zhì)子和中子組成,質(zhì)子帶正電荷,中子不帶電荷。電子則帶負(fù)電荷,質(zhì)子和電子的電量大小相等。
原子結(jié)構(gòu)的描述是基于量子力學(xué)的理論的,在量子力學(xué)中,電子的運動方式被描述為波函數(shù),而不是具體的路徑。波函數(shù)的平方值給出了電子出現(xiàn)在某一位置的概率。電子的運動方式是分立的,只能處于離散的能級上。
電子圍繞原子核運動的軌道被稱為能級,每個能級可以容納不同數(shù)量的電子。能級與電子的能量緊密相關(guān),能級越高,電子的能量越高。在一個原子中,電子是按照一定規(guī)則分布在不同的能級上。
根據(jù)泡利不相容原理,每個能級最多容納的電子數(shù)目由能級的2n^2公式?jīng)Q定,其中n表示能級的主量子數(shù)。具體地說,第一個能級(n=1)最多容納2個電子,第二個能級(n=2)最多容納8個電子,第三個能級(n=3)最多容納18個電子,以此類推。
從上述規(guī)則可以推導(dǎo)出,次外層電子的數(shù)量等于其所在的能級n減去1乘以2:
次外層電子數(shù) = (n - 1) × 2
因此,次外層電子的數(shù)量是能級數(shù)目對應(yīng)的最大次外層電子數(shù)目。最大的次外層電子數(shù)目可以通過確定原子的主量子數(shù)來得到。
舉例來說,對于氫原子(H),它只有一個電子,該電子處于第一能級(n=1),因此次外層電子數(shù)為0。
再以氧原子(O)為例,氧原子有8個電子,根據(jù)規(guī)則,這些電子會按照能級順序填充。氧原子的電子排布可以用1s2 2s2 2p4表示,其中1s、2s和2p分別代表不同的能級,數(shù)字2表示每個能級所容納的電子數(shù)。
根據(jù)次外層電子的數(shù)量可以進(jìn)一步得出原子的化學(xué)性質(zhì)。次外層電子的數(shù)目對原子的反應(yīng)性和化學(xué)鍵的形成有重要影響。例如,當(dāng)元素具有完全填滿的次外層電子時,它們更加穩(wěn)定,因此不容易與其他元素發(fā)生化學(xué)反應(yīng)。這種穩(wěn)定的次外層電子配置被稱為稀有氣體結(jié)構(gòu)。
總結(jié)起來,原子結(jié)構(gòu)中的次外層電子數(shù)目由原子的主量子數(shù)決定,根據(jù)2n^2的規(guī)則,能級越高,次外層電子數(shù)量越多。通過了解和分析次外層電子的數(shù)量,我們可以更好地理解原子行為以及元素的化學(xué)性質(zhì)。
-
電荷
+關(guān)注
關(guān)注
1文章
652瀏覽量
36686 -
函數(shù)
+關(guān)注
關(guān)注
3文章
4374瀏覽量
64395 -
量子力學(xué)
+關(guān)注
關(guān)注
8文章
101瀏覽量
21134 -
化學(xué)反應(yīng)
+關(guān)注
關(guān)注
0文章
18瀏覽量
6032
發(fā)布評論請先 登錄
氯離子結(jié)構(gòu)示意圖和鈉離子結(jié)構(gòu)示意圖

游標(biāo)卡尺的結(jié)構(gòu)及示意圖






 原子結(jié)構(gòu)示意圖次外層電子不超過多少
原子結(jié)構(gòu)示意圖次外層電子不超過多少
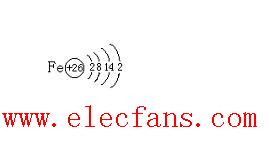














評論