超聲基因轉(zhuǎn)移比其他細胞轉(zhuǎn)移技術(shù)更有優(yōu)勢,因為超聲不直接作用于細胞,而是通過聲孔效應(yīng)將細胞周圍的基因片段推入細胞。據(jù)麥姆斯咨詢報道,近日,一支由中國廣西大學和中國科學院智能機械研究所的研究人員組成的團隊在Micromachines期刊上發(fā)表了題為“A Microfluidic System of Gene Transfer by Ultrasound”的論文。該論文提出的微流控系統(tǒng)對于開發(fā)用于癌癥早期診斷和癌癥治療評估的單細胞生物芯片平臺具有重要意義。
從外源向細胞的基因轉(zhuǎn)移是一項基本的生物工程技術(shù),也是表征基因結(jié)構(gòu)和功能的有力工具。目前用于裸基因轉(zhuǎn)移的被動方法包括:脂質(zhì)體介導(dǎo)法、微注射法和病毒載體轉(zhuǎn)染法等。裸基因轉(zhuǎn)移的被動方法具有無需外部供能、設(shè)備簡單等優(yōu)點,但載體,尤其是病毒載體,存在局限性和安全缺陷。雖然脂質(zhì)體、高分子材料和納米基因轉(zhuǎn)運蛋白等非病毒載體沒有病毒毒性或免疫原性等缺陷,但它們的傳輸效率非常低。
裸DNA轉(zhuǎn)移的主動方法包括:微注射、粒子轟擊/粒子槍、電穿孔和光學方法。微注射和粒子轟擊都是介入方法;也就是說,細胞膜必須穿孔才能將DNA導(dǎo)入細胞。電穿孔基因轉(zhuǎn)移也需要細胞膜穿孔,它利用高壓電擊(10–20kV/cm)將DNA質(zhì)粒通過細胞膜后轉(zhuǎn)移到細胞內(nèi)。目前,電穿孔是最常用的一種方法,因為電穿孔具有轉(zhuǎn)染效率高和適用于大型DNA質(zhì)粒的優(yōu)點,但其操作需要低離子水平的培養(yǎng)基和高電壓,這可能導(dǎo)致細胞死亡。此外,高聚焦激光還可用于在細胞膜上產(chǎn)生直徑約1μm的穿孔,這是光學基因轉(zhuǎn)移的原理。然而,激光束很容易損傷細胞,這大大限制了該方法的應(yīng)用。光學基因轉(zhuǎn)移特別適用于一次僅處理一個細胞的單細胞轉(zhuǎn)染。

圖1 超聲DNA轉(zhuǎn)移機理的示意圖
超聲介導(dǎo)的基因轉(zhuǎn)移,也被稱為聲孔效應(yīng),是近年來開發(fā)的一種細胞膜滲透技術(shù),已被應(yīng)用于細胞內(nèi)的DNA和藥物轉(zhuǎn)移。該技術(shù)基于超聲波的空化效應(yīng)。當超聲波在液體溶液中傳播時,路徑中的液體將經(jīng)歷交替壓縮和膨脹。如果超聲強度足夠大,液體在壓縮和膨脹過程中會形成氣泡,并能在膨脹到一定程度后破裂。從氣泡產(chǎn)生到破裂的時間通常非常短,通常在1μs以內(nèi)。該過程被稱為超聲空化。超聲空化產(chǎn)生的局部高溫高壓沖擊波可以在細胞膜上形成有效直徑小于100nm的微孔。這些微孔可以持續(xù)幾秒鐘,讓較大的分子從培養(yǎng)基進入細胞。在優(yōu)化的條件下,細胞可以在空化效應(yīng)下存活,且無明顯損傷。基于自修復(fù)機理,基因轉(zhuǎn)染后細胞膜可以自行橋接。以上是超聲介導(dǎo)的基因轉(zhuǎn)移的原理。圖1顯示了超聲介導(dǎo)的DNA轉(zhuǎn)移機理和DNA質(zhì)粒轉(zhuǎn)移到細菌細胞內(nèi)的典型步驟。
該技術(shù)目前被認為是將DNA質(zhì)粒或片段轉(zhuǎn)染到細胞內(nèi)的理想方法。它具有以下優(yōu)點:(a)理論上,DNA或RNA可以被轉(zhuǎn)移到任何類型的細胞,包括細菌細胞、植物細胞和哺乳動物細胞;(b)它不要求培養(yǎng)基是無離子的,并且可用于在自然環(huán)境或人體內(nèi)生長的細胞;(c)它是非侵入性的,不需要與細胞直接接觸;(d)人們可以很容易控制轉(zhuǎn)移的時間和位置。超聲可以被限制在特定的區(qū)域或時間段,以改善基因轉(zhuǎn)移的效果。
現(xiàn)有的超聲介導(dǎo)的基因轉(zhuǎn)移技術(shù)都是在宏觀體積下使用大型超聲設(shè)備(例如喇叭形超聲輻射器或超聲浴)進行的。相關(guān)研究僅在宏觀尺度(10?–10?個細胞)上進行,并得出平均數(shù)據(jù)。由于細胞反應(yīng)的不均勻性和不同的生命或代謝周期,平均數(shù)據(jù)往往難以解讀。為了解決這個問題,需要開發(fā)單細胞操作、高精度分析和高靈敏度檢測的新技術(shù)和新裝置。有趣的是,利用微流控技術(shù),生物芯片——“芯片實驗室”(lab-on-a-chip)的尺寸與細胞尺寸是兼容的,適合單細胞操作。
與宏觀和大體積分析技術(shù)相比,集成生物芯片技術(shù)具有試劑消耗小、殘留物少、反應(yīng)時間短、精度高、成本效益好、一次性使用等優(yōu)點。微流控裝置的使用有利于細胞的分離、捕獲、定位和觀察。此外,人們可以控制附著細胞的器件表面物理和化學參數(shù),例如局部pH值和溫度,以精確控制細胞周圍的局部環(huán)境。
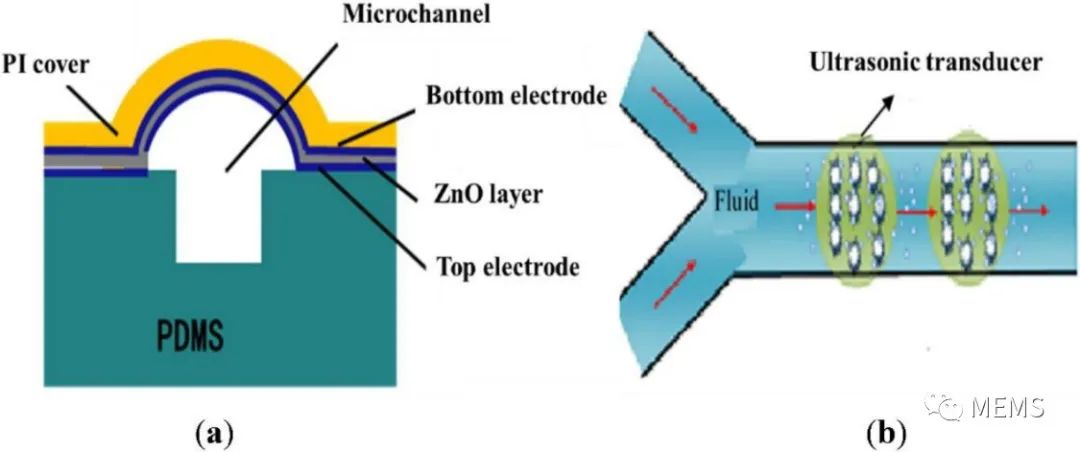
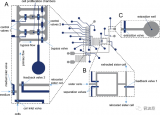
圖2 微流控超聲基因轉(zhuǎn)移系統(tǒng)示意圖
在本論文研究中,作者們將基于柔性基底壓電薄膜的MEMS聚焦超聲換能器與微通道集成,提出了一個能夠滿足高精度分析和單細胞操作要求的微流控超聲基因轉(zhuǎn)移系統(tǒng)。該系統(tǒng)的核心部分是一個碗形彎曲的壓電薄膜結(jié)構(gòu),其功能是自動聚焦超聲波。低輸入電壓和功率可以在微通道局部區(qū)域獲得超過空化閾值的聲壓,以減少對細胞的損傷。他們通過有限元仿真驗證了該系統(tǒng)的可行性,開發(fā)了MEMS超聲器件和微通道集成的微流控系統(tǒng),成功開展了HeLa細胞的超聲基因轉(zhuǎn)染實驗。實驗結(jié)果表明,超聲換能器越多,轉(zhuǎn)染率越高。

圖3(a)PI基底上自聚焦超聲換能器陣列的制備流程圖;(b)微流控轉(zhuǎn)染生物芯片。
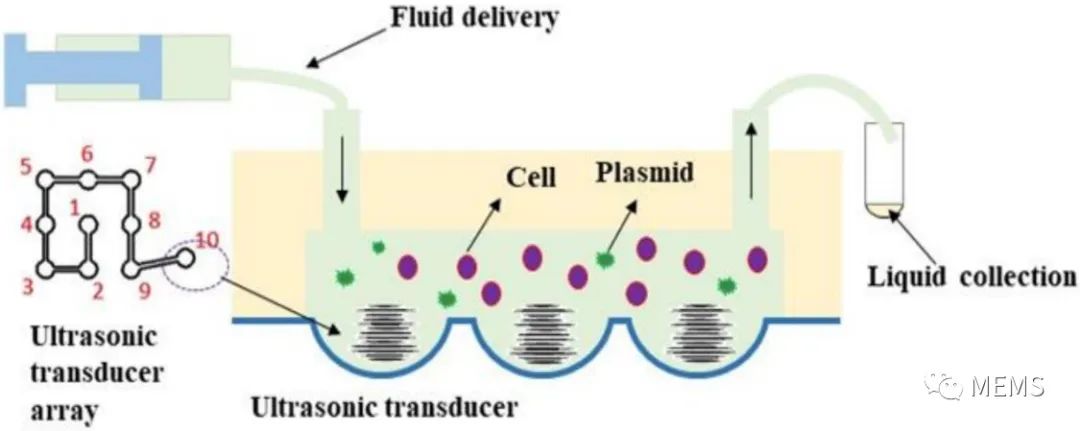
圖4 超聲基因轉(zhuǎn)染實驗示意圖

圖5 HeLa細胞中綠色熒光蛋白表達結(jié)果(×200):(a)僅添加質(zhì)粒;(b)添加質(zhì)粒并用2 號換能器超聲處理20s;(c)添加質(zhì)粒并用4號換能器超聲處理20s;(d)添加質(zhì)粒并用2號和4號換能器同時超聲處理20s。
審核編輯:郭婷
-
mems
+關(guān)注
關(guān)注
129文章
4080瀏覽量
192833 -
換能器
+關(guān)注
關(guān)注
8文章
351瀏覽量
30014
原文標題:基于MEMS超聲換能器的基因轉(zhuǎn)移微流控系統(tǒng)
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
微流控生物芯片的磁場仿真及實驗對比
生物芯片分類及應(yīng)用
微流控芯片在單細胞捕獲中的應(yīng)用
廈門大學研發(fā)出全新高通量單細胞轉(zhuǎn)錄組測序方法
青島能源所開發(fā)出高覆蓋度的單細胞拉曼分選-測序技術(shù)
一種低成本的單細胞(single-cell)微流控芯片

基于微流控平臺的單細胞通訊研究進展
北京基因組所開發(fā)出新型高通量單細胞多組學技術(shù)
基于載酶金屬有機框架的微流控平臺實現(xiàn)單細胞代謝物分析
一種用于測量單細胞瞬態(tài)響應(yīng)的封閉式微流控芯片
用于單細胞譜系追蹤圖像引導(dǎo)的微流控系統(tǒng)





 基于微流控系統(tǒng)開發(fā)單細胞生物芯片平臺
基于微流控系統(tǒng)開發(fā)單細胞生物芯片平臺












評論