一個受精卵發育為一個復雜個體,正常體細胞變成腫瘤細胞,細胞作為生命的基本單位,其狀態的動態變化既是健康發育的基礎也是疾病產生的原因。從光學顯微鏡對細胞形態變化的觀察,到綠色熒光蛋白對細胞基因、表達定位等變化的追蹤,再到分子記錄器在基因組中穩定寫入曾經發生的分子事件,以及單細胞轉錄組測序的發展,允許細胞全轉錄組的變化擬時序推測,每一次細胞動態變化記錄的技術變革均推動了細胞生物學的發展。既有方法或受限于對細胞形態或少數基因的動態表征,或依賴于擬時序分析中多種在實際細胞體系中可能無法滿足的假設,目前尚不能直接測量細胞全轉錄組狀態變化。
8月17日,中國科學院深圳先進技術研究院、瑞士洛桑聯邦理工學院Bart Deplancke課題組、蘇黎世聯邦理工學院Julia Vorholt課題組合作,在《自然》(Nature)上以article長文形式,發表了題為Live-seq enables temporal transcriptomic recording of single cells的研究論文。
該研究開發了活細胞轉錄組測序技術(Live-seq),首次實現了單細胞進行轉錄組測序后依然能夠保持細胞存活。該技術兼具全基因表達分辨率和動態解析能力,是當前對單細胞轉錄組直接動態測量、偶聯細胞現有狀態及其后續表型的唯一解決方案。
基因表達程序的變化是細胞對外源和內源刺激反應的重要表現。對單個細胞的連續觀測是細胞對刺激反應、變化的重要研究手段,活細胞成像是最早的方法之一。隨著顯微成像技術和熒光標記手段的發展,顯微成像可實現從體外細胞培養到體內環境下對基因表達的動態觀測。基因編輯技術的發展促進分子記錄器的出現。該技術通過細胞原生的或人工合成的基因線路,對刺激的感應并將信息寫入基因組,記錄歷史分子事件。技術的發展和應用促進細胞生物學的發展,例如活細胞成像已成為現代細胞生物學實驗室的常用手段;分子記錄器雖出現不久,但在體內多場景的適用性和穩定性上頗具潛力。而它們在記錄基因表達上存在共同的限制——在一個細胞中只能同時記錄一個或幾個基因的表達。
2009年湯富酬首創單細胞mRNA測序以來,不再只依靠少數幾個基因的表達來分析細胞類型,而可用整個轉錄組的狀態來更系統全面的定義細胞類型和狀態。單細胞轉錄組變革了對細胞狀態異質性的解析能力,推動了發育生物學、腫瘤細胞學、免疫學和干細胞生物學等的發展。然而,研究只可測量細胞的靜態狀態,無法像前述的活細胞成像那樣連續觀測細胞的動態或檢查細胞后續的表型。為了克服這一限制,多種基于計算或標記的方法被開發出來。這些方法基于共同的假設,即群體的靜態分布可以模擬個體的動態運動。運用不同的數學模型和/或新舊RNA的標記等手段,研究將轉錄組相似的細胞連接,產生一條軌跡來代表一個細胞的變化路徑。這些方法提供了有意義的生物學認知,但由于這些前提假設在復雜細胞系統不一定能被滿足,其提供的變化路徑應被解讀為一種統計學上的預期,而非細胞真正變化的軌跡。而這些限制的根本原因在于單細胞測序時裂解殺死了細胞,因而無法連續測量。
本研究中,科研人員開發出活細胞轉錄組測序技術(Live-seq),在進行單細胞轉錄組測序后,依舊保持細胞的存活和功能。該技術的核心是對部分細胞質進行微創地提取,并對微量的細胞質RNA進行擴增。具體地,該技術整合改造了多種跨學科技術(圖1):具備納米級移動分辨率和皮牛頓力學靈敏度的原子力顯微鏡,實現超精密顯微操作;亞皮升級別的微/納流控通道和液壓調節系統,實現微量(約1皮升)樣品提取和轉移;納米級的、中空可定量的、可和細胞膜無縫密封的特殊探針,可實現微創的細胞質提取;相偶聯的實時跟蹤成像和細胞培養系統,可以長時間鎖定同一個細胞;高靈敏度的RNA擴增測序;對前述步驟的無縫整合。
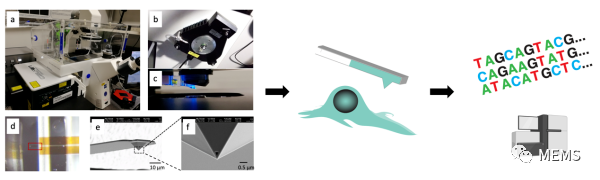
圖1 Live-seq基本原理
Live-seq只對少量的細胞質進行測序,其結果能否代表細胞的狀態?研究對多種類型和狀態的細胞進行活細胞測序,并平行地和單細胞測序結果進行比較。結果顯示活細胞測序結果和單細胞測序結果高度吻合,證明了Live-seq能夠較好的體現細胞的全轉錄組狀態。這一過程是否改變細胞狀態甚至殺死細胞?研究對包括干細胞在內的多種細胞類型進行評估,發現大部分細胞在Live-seq后仍然存活。同時,細胞分裂依然能夠正常進行(圖2)。研究通過對巨噬細胞對細菌脂多糖LPS刺激的反應和脂肪干細胞分化過程的觀測發現,細胞的反應未因Live-seq而有明顯變化。研究對接受和未接受細胞質提取的細胞全轉錄組進行比較,也未發現大量的基因表達變化。結果顯示,Live-seq未對細胞的活性和功能產生較大影響。
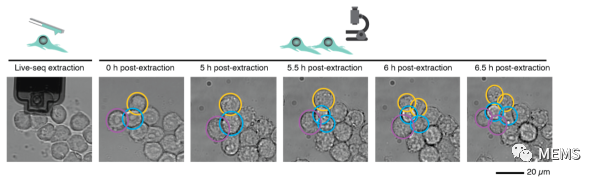
圖2 Live-seq對細胞的影響,黃色的細胞被提取出細胞質,藍色和紫色的細胞未被處理
由于細胞測試后仍舊存活,Live-seq首次實現對同一個細胞全基因表達的連續測量。作為概念驗證,Live-seq直接測定了同一個巨噬細胞和脂肪干細胞在刺激前后的變化路徑(圖3)。Live-seq可以回答細胞怎樣的過去決定它的現在。即使是單克隆來源的巨噬細胞對細菌脂多糖的反應依舊有很大的異質性。利用這一模型,研究表明起始狀態的少數基因的表達差異和噪音(如Nfkbia、Gsn等)是決定細胞后續反應差異的重要原因,處于細S期的細胞對刺激反應也更弱。對應地,普通的單細胞轉錄組無法找到這些規律。
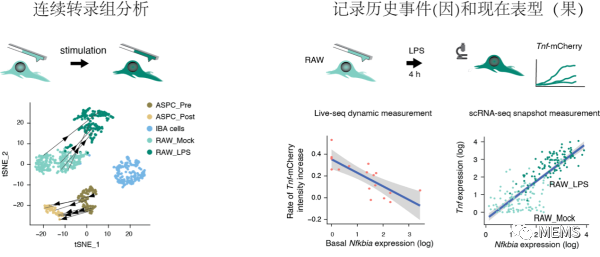
圖3 活細胞測序新可能:(左圖)對同一個細胞轉錄組的連續分析;(右圖)偶聯細胞起始的轉錄組狀態(因)和后續細胞對刺激的反應(果)
Live-seq仍有不足:與高通量的單細胞轉錄組相比,Live-seq是低通量的手段;Live-seq尚不能在體內應用;在高度極化而mRNA分布不均的細胞(如神經細胞)中,Live-seq或無法體現全細胞轉錄組;多次采樣對細胞的干擾需要更多研究。未來持續的發展如自動化提高通量、通過和雙光子顯微鏡聯用運用于體內樣品等,有望使上述不足得到改善。Live-seq第一次使得對活細胞的連續觀測成為可能,希望可以催生更多新可能。
研究工作得到國家重點研發計劃、深圳合成生物創新研究院的支持。
論文鏈接:
https://www.nature.com/articles/s41586-022-05046-9
審核編輯 :李倩
-
RNA
+關注
關注
0文章
46瀏覽量
9887 -
測序
+關注
關注
0文章
41瀏覽量
8419
原文標題:科學家開發出活細胞轉錄組測序技術(Live-seq)
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
功率放大器在液滴微流控細胞分選中的應用

太赫茲細胞能量儀主控芯片方案單片機開發控制板布局規劃
索尼BRC-AM7如何簡化live house拍攝流程
函數HAL_I2C_Slave_Seq_Transmit_IT和HAL_I2C_Slave_Seq_Receive_IT實現代碼里有處理DMA請求,這是出于什么考慮?
DS1678實時事件記錄器技術手冊
Orange Business推出Live Intelligence:簡化企業級生成式AI部署
應用于活細胞成像的一次性細胞培養芯片
基于玻璃基底的細胞培養芯片研究(下)
活細胞的“聚光燈”——前沿活細胞成像的案例分享

ATG-2000系列功率信號源在介電電泳細胞分選測試中的應用

從記錄到管理:單北斗工作記錄儀如何優化工作流程

寬帶功率放大器基于微流控技術的細胞分選的應用
射頻功率放大器在超聲實現離體腫瘤細胞研究的應用





 Live seq允許單細胞的時間轉錄組記錄
Live seq允許單細胞的時間轉錄組記錄










評論