元素周期表
我們現在知道,一般的原子和物質材料的結構組成比玻爾模型復雜得多,質子和中子也可以進一步細分為更小的部分。
幸運的是,這個模型確實描述了元素的基本結構,可以解釋不同元素的屬性。元素之間的電子、質子和中子的數量不同。大自然把亞原子粒子有序地結合在一起。了解一些支配原子結構的規則,有助于我們了解半導體材料和加工化學品的特性。原子(也就是元素)的范圍從最簡單的氫(1電子),到最復雜的一個,鐒元素(有103個電子)。氫在原子核中只有一個質子和一個電子。
這排列說明了原子結構的第一條規則:在每一個在原子中,質子和電子的數量是相等的。2.每個元素都有特定數量的質子,沒有兩個元素有相同數量的質子。比如氫,它有一個質子原子核,而氧原子有八個。
為呈現這一具體規律,科學家們為每個元素分配數字,作為原子序數,它等于質子數(因此原子中的電子。元素的基本參考是元素周期表(下圖所示)。元素周期表中每個元素都有一個方框,也就是由兩個字母確定。原子序數在左上角這個位置。因此,鈣(Ca)的原子序數是20,所以我們知道鈣原子的原子核里有20個質子和20個電子統。中子是一種電中性粒子,它和質子一起形成增加了原子核的質量。
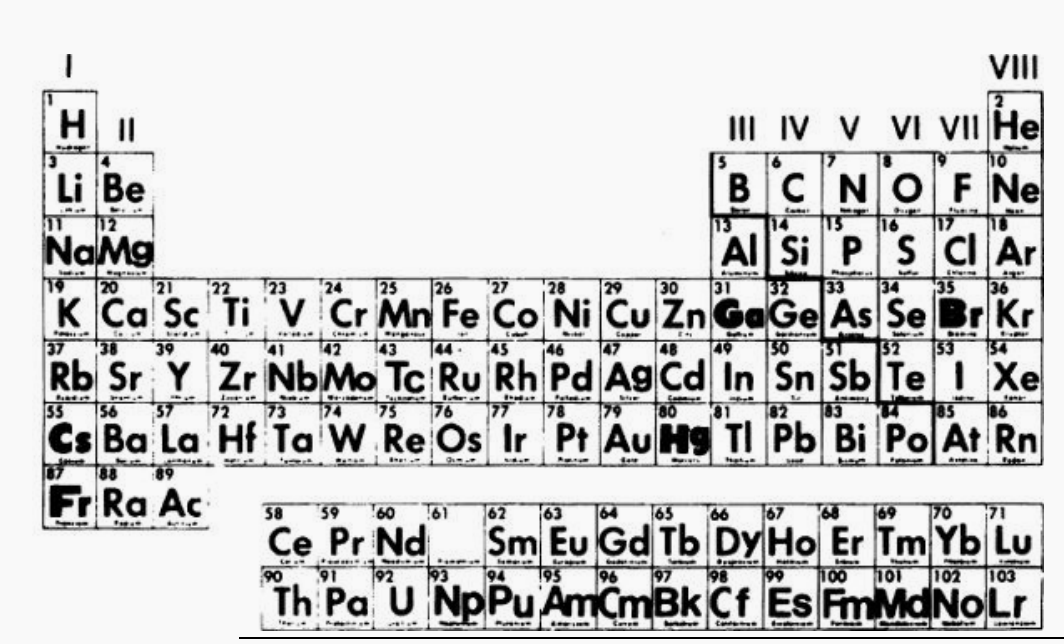
元素的原子結構如下圖所示。1、氫;2、鋰;11、鈉。在構建圖表時,有幾個規則電子在它們的軌道上的位置。規則是:每個軌道(n)都能容納2n^ 2個電子。軌道的數學解中的1表示:第一個電子軌道只能容納兩個電子。這條規則迫使鋰的第三個電子進入第二環。該規則限制了第二環的電子數為8,第三環的電子數為18。所以,在構建鈉原子的圖解時它有11個質子和電子,前兩個軌道占用10個電子,第11個在第三個軌道。
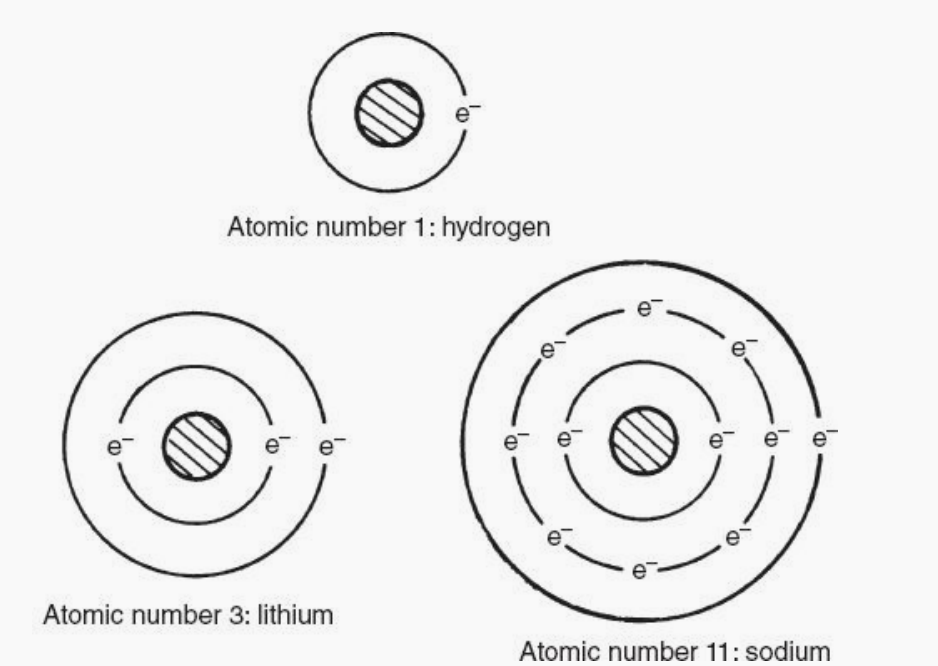
這三個原子有一個共性。每個原子的外圈里面只有一個電子。這說明了元素的另一個可觀察到的事實。
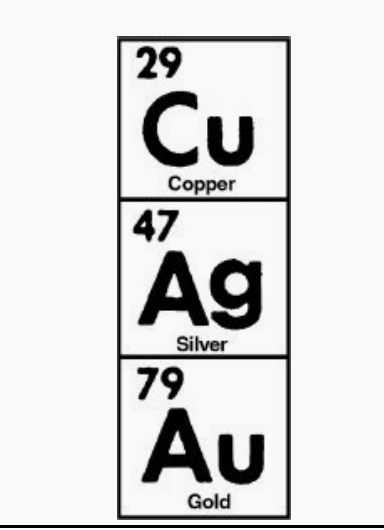
具有相同數量外軌道電子的元素具有相似的屬性。這一規律反映在元素周期表中。注意氫,鋰和鈉出現在表格中一個垂直的列上,標有羅馬數字1 (I)。列號代表的是數外環上的電子和每一列上的所有元素有相似的屬性。所據此我們可以解釋是,三種最好的導電體(銅、銀、和金)都出現在元素周期表的同一列(Ib)(下圖所示)。原子結構還有兩個規則可以了解半導體。
元素的最外圈被填滿或內部有8個電子時是穩定的結構。這些原子在化學上比有部分填充的元素更加的穩定。原子尋求與其他原子結合以創造穩定的狀態,通過形成共享電子的方式,形成在最外圈達到8個電子上網穩定態。上面兩個規則影響了n型和p型半導體材料的產生。
審核編輯:劉清
-
半導體
+關注
關注
335文章
28713瀏覽量
234419
原文標題:半導體行業(二百一十七)之半導體材料特性(二)
文章出處:【微信號:FindRF,微信公眾號:FindRF】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄






 半導體行業之半導體材料特性(二)
半導體行業之半導體材料特性(二)












評論