li ion是什么意思?
鋰離子電池(Li-ion Batteries)是鋰電池發展而來。所以在介紹Li-ion之前,先介紹鋰電池。舉例來講,以前照相機里用的扣式電池就屬于鋰電池。鋰電池的正極材料是二氧化錳或亞硫酰氯,負極是鋰。電池組裝完成后電池即有電壓,不需充電.這種電池也可能充電,但循環性能不好,在充放電循環過程中,容易形成鋰枝晶,造成電池內部短路,所以一般情況下這種電池是禁止充電的。后來,日本索尼公司發明了以炭材料為負極,以含鋰的化合物作正極,在充放電過程中,沒有金屬鋰存在,只有鋰離子,這就是鋰離子電池。當對電池進行充電時,電池的正極上有鋰離子生成,生成的鋰離子經過電解液運動到負極。而作為負極的碳呈層狀結構,它有很多微孔,達到負極的鋰離子就嵌入到碳層的微孔中,嵌入的鋰離子越多,充電容量越高。同樣,當對電池進行放電時(即我們使用電池的過程),嵌在負極碳層中的鋰離子脫出, 又運動回正極。回正極的鋰離子越多,放電容量越高。我們通常所說的電池容量指的就是放電容量。在Li-ion的充放電過程中,鋰離子處于從正極→負極→正極的運動狀態。Li-ion Batteries就像一把搖椅,搖椅的兩端為電池的兩極,而鋰離子就象運動員一樣在搖椅來回奔跑。所以Li-ion Batteries又叫搖椅式電池。
鋰離子電池電池組成部分
(1)電池上下蓋
(2)正極——活性物質一般為氧化鋰鈷
(3)隔膜——一種特殊的復合膜
(4)負極——活性物質為碳
(5)有機電解液
(6)電池殼(分為鋼殼和鋁殼兩種)
鋰離子電池優缺點
鋰離子電池具有以下優點:
1) 電壓高,單體電池的工作電壓高達3.6-3.9V,是Ni-Cd、Ni-H電池的3倍
2) 比能量大,目前能達到的實際比能量為100-125Wh/kg和240-300Wh/L(2倍于Ni-Cd,1.5倍于Ni-MH),未來隨著技術發展,比能量可高達150Wh/kg和400 Wh/L
3) 循環壽命長,一般均可達到500次以上,甚至1000次以上.對于小電流放電的電器,電池的使用期限 將倍增電器的競爭力.
4) 安全性能好,無公害,無記憶效應.作為Li-ion前身的鋰電池,因金屬鋰易形成枝晶發生短路,縮減了其應用領域:Li-ion中不含鎘、鉛、汞等對環境有污染的元素:部分工藝(如燒結式)的Ni-Cd電池存在的一大弊病為“記憶效應”,嚴重束縛電池的使用,但Li-ion根本不存在這方面的問題。
5) 自放電小,室溫下充滿電的Li-ion儲存1個月后的自放電率為10%左右,大大低于Ni-Cd的25-30%,Ni、MH的30-35%。
6) 可快速充放電,1C充電是容量可以達到標稱容量的80%以上。
7) 工作溫度范圍高,工作溫度為-25~45°C,隨著電解質和正極的改進,期望能擴寬到-40~70°C。
鋰離子電池也存在著一定的缺點,如:
1) 電池成本較高。主要表現在正極材料LiCoO2的價格高(Co的資源較小),電解質體系提純困難。
2) 不能大電流放電。由于有機電解質體系等原因,電池內阻相對其他類電池大。故要求較小的放電電流密度,一般放電電流在0.5C以下,只適合于中小電流的電器使用。
3) 需要保護線路控制。
A、 過充保護:電池過充將破壞正極結構而影響性能和壽命;同時過充電使電解液分解,內部壓力過高而導致漏液等問題;故必須在4.1V-4.2V的恒壓下充電;
B、 過放保護:過放會導致活性物質的恢復困難,故也需要有保護線路控制。
摘要:綜述了鋰離子電池的發展趨勢,簡述了鋰離子電池的充放電機理理論研究狀況,總結歸納了作為核心技術的鋰電池正負電極材料的現有的制備理論和近來發展動態,評述了正極材料和負極材料的各種制備方法和發展前景,重點介紹了目前該領域的問題和改進發展情況。
電子信息時代使對移動電源的需求快速增長。由于鋰離子電池具有高電壓、高容量的重要優點,且循環壽命長、安全性能好,使其在便攜式電子設備、電動汽車、空間技術、國防工業等多方面具有廣闊的應用前景,成為近幾年廣為關注的研究熱點。鋰離子電池的機理一般性分析認為,鋰離子電池作為一種化學電源,指分別用兩個能可逆地嵌入與脫嵌鋰離子的化合物作為正負極構成的二次電池。當電池充電時,鋰離子從正極中脫嵌,在負極中嵌入,放電時反之。鋰離子電池是物理學、材料科學和化學等學科研究的結晶。鋰離子電池所涉及的物理機理,目前是以固體物理中嵌入物理來解釋的,嵌入(intercalation)是指可移動的客體粒子(分子、原子、離子)可逆地嵌入到具有合適尺寸的主體晶格中的網絡空格點上。電子輸運鋰離子電池的正極和負極材料都是離子和電子的混合導體嵌入化合物。電子只能在正極和負極材料中運動[4][5][6]。已知的嵌入化合物種類繁多,客體粒子可以是分子、原子或離子.在嵌入離子的同時,要求由主體結構作電荷補償,以維持電中性。電荷補償可以由主體材料能帶結構的改變來實現,電導率在嵌入前后會有變化。鋰離子電池電極材料可穩定存在于空氣中與其這一特性息息相關。嵌入化合物只有滿足結構改變可逆并能以結構彌補電荷變化才能作為鋰離子電池電極材料。
控制鋰離子電池性能的關鍵材料——電池中正負極活性材料是這一技術的關鍵,這是國內外研究人員的共識。
1 正極材料的性能和一般制備方法
正極中表征離子輸運性質的重要參數是化學擴散系數,通常情況下,正極活性物質中鋰離子的擴散系數都比較低。鋰嵌入到正極材料或從正級材料中脫嵌,伴隨著晶相變化。因此,鋰離子電池的電極膜都要求很薄,一般為幾十微米的數量級。正極材料的嵌鋰化合物是鋰離子電池中鋰離子的臨時儲存容器。為了獲得較高的單體電池電壓,傾向于選擇高電勢的嵌鋰化合物。正極材料應滿足:
1)在所要求的充放電電位范圍內,具有與電解質溶液的電化學相容性;
2)溫和的電極過程動力學;
3)高度可逆性;
4)全鋰化狀態下在空氣中的穩定性。
研究的熱點主要集中在層狀LiMO2和尖晶石型LiM2O4結構的化合物及復合兩種M(M為Co,Ni,Mn,V等過渡金屬離子)的類似電極材料上。作為鋰離子電池的正極材料,Li+離子的脫嵌與嵌入過程中結構變化的程度和可逆性決定了電池的穩定重復充放電性。正極材料制備中,其原料性能和合成工藝條件都會對最終結構產生影響。多種有前途的正極材料,都存在使用循環過程中電容量衰減的情況,這是研究中的首要問題。已商品化的正極材料有Li1-xCoO2(0
1)固相法一般選用碳酸鋰等鋰鹽和鈷化合物或鎳化合物研磨混合后,進行燒結反應[10]。此方法優點是工藝流程簡單,原料易得,屬于鋰離子電池發展初期被廣泛研究開發生產的方法,國外技術較成熟;缺點是所制得正極材料電容量有限,原料混合均勻性差,制備材料的性能穩定性不好,批次與批次之間質量一致性差。
2)絡合物法用有機絡合物先制備含鋰離子和鈷或釩離子的絡合物前驅體,再燒結制備。該方法的優點是分子規模混合,材料均勻性和性能穩定性好,正極材料電容量比固相法高,國外已試驗用作鋰離子電池的工業化方法,技術并未成熟,國內目前還鮮有報道。
3)溶膠凝膠法利用上世紀70年代發展起
來的制備超微粒子的方法,制備正極材料,該方法具備了絡合物法的優點,而且制備出的電極材料電容量有較大的提高,屬于正在國內外迅速發展的一種方法。缺點是成本較高,技術還屬于開發階段[11]。
4)離子交換法Armstrong等用離子交換法制備的LiMnO2,獲得了可逆放電容量達270mA·h/g高值,此方法成為研究的新熱點,它具有所制電極性能穩定,電容量高的特點。但過程涉及溶液重結晶蒸發等費能費時步驟,距離實用化還有相當距離。
正極材料的研究從國外文獻可看出,其電容量以每年30~50mA·h/g的速度在增長,發展趨向于微結構尺度越來越小,而電容量越來越大的嵌鋰化合物,原材料尺度向納米級挺進,關于嵌鋰化合物結構的理論研究已取得一定進展,但其發展理論還在不斷變化中。困擾這一領域的鋰電池電容量提高和循環容量衰減的問題,已有研究者提出添加其它組分來克服的方法[12][13][14][15][16][17]。但就目前而言,這些方法的理論機理并未研究清楚,導致日本學者Yoshio.Nishi認為,過去十年以來在這一領域實質進展不大[1],急須進一步地研究。
2 負極材料的性能和一般制備方法
負極材料的電導率一般都較高,則選擇電位盡可能接近鋰電位的可嵌入鋰的化合物,如各種碳材料和金屬氧化物。可逆地嵌入脫嵌鋰離子的負極材料要求具有:
1)在鋰離子的嵌入反應中自由能變化小;
2)鋰離子在負極的固態結構中有高的擴散率;
3)高度可逆的嵌入反應;
4)有良好的電導率;
5)熱力學上穩定,同時與電解質不發生反應。
研究工作主要集中在碳材料和具有特殊結構的其它金屬氧化物。石墨、軟碳、中相碳微球已在國內有開發和研究,硬碳、碳納米管、巴基球C60等多種碳材料正在被研究中[18][19][20][21][22][23]。日本Honda Researchand Development Co.,Ltd的K.Sato等人利用聚對苯撐乙烯(Polyparaphenylene——PPP)的熱解產物PPP-700(以一定的加熱速度加熱PPP至700℃,并保溫一定時間得到的熱解產物)作為負極,可逆容量高達680mA·h/g。美國MIT的MJMatthews報道PPP-700儲鋰容量(Storagecapacity)可達1170mA·h/g。若儲鋰容量為1170mA·h/g,隨著鋰嵌入量的增加,進而提高鋰離子電池性能,筆者認為今后研究將集中于更小的納米尺度的嵌鋰微結構。幾乎與研究碳負極同時,尋找電位與Li+/Li電位相近的其他負極材料的工作一直受到重視。鋰離子電池中所用碳材料尚存在兩方面的問題:
1)電壓滯后,即鋰的嵌入反應在0~0.25V之間進行(相對于Li+/Li)而脫嵌反應則在1V左右發生;
2)循環容量逐漸下降,一般經過12~20次循環后,容量降至400~500mA·h/g。
理論上的進一步深化還有賴于各種高純度、結構規整的原料及碳材料的制備和更為有效的結構表征方法的建立。日本富士公司開發出了鋰離子電池新型錫復合氧化物基負極材料,除此之外,已有的研究主要集中于一些金屬氧化物,其質量比能量較碳負極材料大大提高。如SnO2,WO2,MoO2,VO2,TiO2,LixFe2O3,Li4Ti5O12,Li4Mn5O12等[24],但不如碳電極成熟。鋰在碳材料中的可逆高儲存機理主要有鋰分子Li2形成機理、多層鋰機理、晶格點陣機理、彈性球-彈性網模型、層-邊端-表面儲鋰機理、納米級石墨儲鋰機理、碳-鋰-氫機理和微孔儲鋰機理。石墨,作為碳材料中的一種,早就被發現它能與鋰形成石墨嵌入化合物(Graphite Intercalation Compounds)LiC6,但這些理論還處于發展階段。負極材料要克服的困難也是一個容量循環衰減的問題,但從文獻可知,制備高純度和規整的微結構碳負極材料是發展的一個方向。
一般制備負極材料的方法可綜述如下。
1)在一定高溫下加熱軟碳得到高度石墨化的碳;嵌鋰石墨離子型化合物分子式為LiC6,其中的鋰離子在石墨中嵌入和脫嵌過程動態變化,石墨結構與電化學性能的關系,不可逆電容量損失原因和提高方法等問題,都得到眾多研究者的探討。2)將具有特殊結構的交聯樹脂在高溫下分解得到的硬碳,可逆電容量比石墨碳高,其結構受原料影響較大,但一般文獻認為這些碳結構中的納米微孔對其嵌鋰容量有較大影響,對其研究主要集中于利用特殊分子結構的高聚物來制備含更多納米級微孔的硬碳[25][26][27]。
3)高溫熱分解有機物和高聚物制備的含氫碳[28][29]。這類材料具有600~900mA·h/g的可逆電容量,因而受到關注,但其電壓滯后和循環容量下降的問題是其最大應用障礙。對其制備方法的改進和理論機理解釋將是研究的重點。
4)各種金屬氧化物其機理與正極材料類似[24],
也受到研究者的注意,研究方向主要是獲取新型結構或復合結構的金屬氧化物。
5)作為一種嵌鋰材料,碳納米管、巴基球C60等也是當前研究的一個新熱點,成為納米材料研究的一個分支。碳納米管、巴基球C60的特殊結構使其成為高電容量嵌鋰材料的最佳選擇[22][23][30]。從理論上說,納米結構可提供的嵌鋰容量會比目前已有的各種材料要高,其微觀結構已被廣泛研究并取得了很大進展,但如何制備適當堆積方式以獲得優異性能的電極材料,這應是研究的一個重要方向[31][32][33]。
3 結語
綜上所述,近年來鋰離子電池中正負極活性材料的研究和開發應用,在國際上相當活躍,并已取得很大進展。材料的晶體結構規整,充放電過程中結構不發生不可逆變化是獲得比容量高,循環壽命長的鋰離子電池的關鍵。然而,對嵌鋰材料的結構與性能的研究仍是該領域目前最薄弱的環節。鋰離子電池的研究是一類不斷更新的電池體系,物理學和化學的很多新的研究成果會對鋰離子電池產生重大影響,比如納米固體電極,有可能使鋰離子電池有更高的能量密度和功率密度,從而大大增加鋰離子電池的應用范圍。總之,鋰離子電池的研究是一個涉及化學、物理、材料、能源、電子學等眾多學科的交叉領域。目前該領域的進展已引起化學電源界和產業界的極大興趣。可以預料,隨著電極材料結構與性能關系研究的深入,從分子水平上設計出來的各種規整結構或摻雜復合結構的正負極材料將有力地推動鋰離子電池的研究和應用。鋰離子電池將會是繼鎳鎘、鎳氫電池之后,在今后相當長一段時間內,市場前景最好、發展最快的一種二次電池。
電池的分類有不同的方法其分類方法大體上可分為三大類
第一類:按電解液種類劃分包括:堿性電池,電解質主要以氫氧化鉀水溶液為主的電池,如:堿性鋅錳電池(俗稱堿錳電池或堿性電池)、鎘鎳電池、氫鎳電池等;酸性電池,主要以硫酸水溶液為介質,如鉛酸蓄電池;中性電池,以鹽溶液為介質,如鋅錳干電池(有的消費者也稱之為酸性電池)、海水激活電池等;有機電解液電池,主要以有機溶液為介質的電池,如鋰電池、鋰離子電池待。
第二類:按工作性質和貯存方式劃分包括:一次電池,又稱原電池,即不能再充電的電池,如鋅錳干電池、鋰原電池等;二次電池,即可充電電池,如氫鎳電池、鋰離子電池、鎘鎳電池等;蓄電池習慣上指鉛酸蓄電池,也是二次電池;燃料電池,即活性材料在電池工作時才連續不斷地 從外部加入電池,如氫氧燃料電池等;貯備電池,即電池貯存時不直接接觸電解液,直到電池使用時,才加入電解液,如鎂-氯化銀電池又稱海水激活電池等。
第三類:按電池所用正、負有為材料劃分包括:鋅系列電池,如鋅錳電池、鋅銀電池等;鎳系列電池,如鎘鎳電池、氫鎳電池等;鉛系列電池,如鉛酸電池等;鋰系列電池、鋰鎂電池;二氧化錳系列電池,如鋅錳電池、堿錳電池等;空氣(氧氣)系列電池,如鋅空電池等
充電電池定義
充電電池又稱:蓄電池、二次電池,是可以反復充電使用的電池。常見的有:鉛酸電池(用于汽車時,俗稱“電瓶”)、鎘鎳電池、氫鎳電池、鋰離子電池。
電池的額定容量
電池的額定容量指在一定放電條件下,電池放電至截止電壓時放出的電量。IEC標準規定鎳鎘和鎳氫電池在20±5℃環境下,以0.1C充電16小時后以0.2C放電至1.0V時所放出的電量為電池的額定容量。單位有Ah, mAh (1Ah=1000mAh)
 電子發燒友App
電子發燒友App





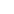















評論