在非線性光學(xué)顯微鏡中,二倍頻(SHG)成像通常用于觀測內(nèi)源性纖維狀結(jié)構(gòu),且 SHG 的強度很大程度上取決于入射光束的偏振方向與目標(biāo)分子取向軸之間的相對角度。因此,基于偏振的 SHG 成像(P-SHG),可通過分析 SHG 信號強度與入射光束的偏振態(tài)之間的函數(shù)關(guān)系,來獲得目標(biāo)分子的結(jié)構(gòu)信息。其現(xiàn)在已用作醫(yī)學(xué)和生物學(xué)分析的重要工具。
簡單的 SHG 圖像可以通過傳統(tǒng)的雙光子激發(fā)熒光顯微鏡(TPM)獲得。大多數(shù) TPM 系統(tǒng)仍采用基于運動鏡面的單束掃描方法,其時間分辨率取決于鏡面的物理移動速度。為了實現(xiàn)更高速的成像,TPM 系統(tǒng)還可以采用多束掃描的方法(圖 1A),其中之一便是利用轉(zhuǎn)盤掃描單元。該單元由共軸的微透鏡轉(zhuǎn)盤和針孔轉(zhuǎn)盤構(gòu)成,兩個轉(zhuǎn)盤上的微透鏡和針孔一一對應(yīng)。
激光在通過微透鏡轉(zhuǎn)盤時,波前會覆蓋多個微透鏡,不同微透鏡將波前各部分聚焦到不同的位置,并穿過對應(yīng)的針孔,形成多個微光束。這些微光束打到樣品上,可同時激發(fā)多個信號。這些信號沿顯微鏡系統(tǒng)返回并再次穿過針孔,最后被兩個轉(zhuǎn)盤之間的二向色鏡反射到檢測裝置中。然而,常規(guī)使用的鎖模鈦寶石激光器作為光源能量不足,限制了激發(fā)光束的數(shù)量,導(dǎo)致使用轉(zhuǎn)盤掃描單元的 TPM (TPM-SD) 的有效視場 (FOV) 很小。
Ai Goto 等人想通過 TPM-SD 系統(tǒng)實現(xiàn)高速的 P-SHG 成像,并保證大的 FOV,故在 TPM-SD 系統(tǒng)中引入了峰值功率更高的基于 Yb 的激光光源。
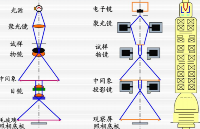
圖 1 是他們開發(fā)的 TPM-SD 系統(tǒng)示意圖。該系統(tǒng)光源為基于 Yb 的激光器,產(chǎn)生的飛秒脈沖中心波長為 1042 nm、平均功率 4 W、脈寬 300 fs,重復(fù)頻率 10 MHz。系統(tǒng)首先通過半波片和格蘭激光偏振器來調(diào)節(jié)激光功率,接著通過擴束器進行擴束,擴束后的光束被引入到轉(zhuǎn)盤掃描單元中,接著從掃描單元出來的多個微光束通過水浸物鏡被聚焦在樣品的多個點上。為了調(diào)整光束在物鏡處的偏振態(tài),激發(fā)光束的光路上放置了一個半波片和一個四分之一波片。
為了測量樣品上入射光束的偏振態(tài),在物鏡后端放置了一個線性偏振膜。在這項研究中,他們使用了圓偏振光(圖 1B;橢圓度 0.95)和 4 種線偏振光束(圖 1C-F;橢圓度 0.2-0.3)。以 FOV 的水平軸為基準(zhǔn),將橫向偏振角設(shè)置為 0、45、90 和 135°。物鏡收集到的熒光或 SHG 光通過針孔轉(zhuǎn)盤,被二向色鏡反射至偏振分束器。偏振分束器將信號分離為一對偏振分辨信號,它們被放大倍數(shù)為×1.2 的中繼透鏡分別聚焦在電子倍增 CCD 相機的不同方形檢測區(qū)域上,從而同時獲取一對矩形圖像。軸向掃描是通過壓電驅(qū)動器實現(xiàn)的。
總之,該組通過 TPM-SD 系統(tǒng),開發(fā)了一種高速的偏振分辨成像方法。他們使用該系統(tǒng)對固定的小鼠皮膚樣品和骨骼肌樣品(離體)以及活體小鼠的骨骼肌進行了成像,證明了該系統(tǒng)能以 56 Hz 的時間分辨率對體內(nèi)組織成像,獲取膠原纖維的結(jié)構(gòu)信息。

圖 1 (A) TPM-SD 系統(tǒng);(B–F) 通過調(diào)整 HWP 和 QWP 的位置,改變?nèi)肷涔饷}沖在樣品上的偏振態(tài)。
非線性成像技術(shù)的優(yōu)化,除了基于圖像獲取模式的優(yōu)化,還可以從先進的圖像處理算法入手。發(fā)展圖像的實時分析工具,以幫助病理學(xué)家快速表征組織特性,實現(xiàn)自動化的病癥診斷,具有極大的推動醫(yī)學(xué)發(fā)展的潛力。目前,用于自動提取疾病特征的用戶獨立算法引起了越來越多的關(guān)注。2019 年,Riccardo Scodellaro 等人開發(fā)了一種針對 P-SHG 的圖像處理方法——μMAPPS(Microscopic Multiparametric Analysis by Phasor projection of Polarization-dependent SHG signal)。其原理是對每個像素的隨入射光偏振態(tài)變化的 SHG 信號()進行二維相量分析,從中分析出各像素對應(yīng)膠原蛋白纖維的平均取向角 (θF)和極化率各向異性參數(shù)(γ,極化率張量χ(2)的非對角線和對角線元素的比),并依此獲得組織細胞外基質(zhì)(ECM)中膠原蛋白的微結(jié)構(gòu)信息。
該組的最終目標(biāo)為無人員操作,全自動化,基于μMAPPS 算法的病理學(xué)診斷:通過區(qū)分不同組織中不同的膠原蛋白結(jié)構(gòu),來區(qū)分正常組織和癌變組織。具體方法為,先通過μMAPPS 重構(gòu)每個像素的和信息,接著,將整個圖像劃分為包含大量感興趣區(qū)域(ROI)的網(wǎng)格,對每個 ROI 的所有像素應(yīng)用聚類算法,將和類似的像素歸為一類(簇),至此,每個 ROI 的像素都被分為了數(shù)十個簇,然后,基于不同 ROI 中不同的分簇,定義一組參數(shù) (p 參數(shù):簇數(shù)(NC),簇元素比(CER,每個簇與最大像素數(shù)量的簇,所含像素數(shù)量之比),和熵(S)), 以量化各 ROI 中膠原蛋白結(jié)構(gòu)的無序性。
最后,以所有 ROI 參數(shù)的平均值為基準(zhǔn),將各 ROI 區(qū)分為正常組織或癌變組織,并對應(yīng)投影回原圖像中。圖 2 是基于熵值的腫瘤邊緣分割結(jié)果。該組通過研究 CT26(結(jié)腸癌)和 4T1(乳腺癌)兩種癌癥模型,測試了該方法自動區(qū)分腫瘤和健康組織區(qū)域的準(zhǔn)確率,并證明熵是在同一組織類型內(nèi),區(qū)分腫瘤與健康區(qū)域,判別腫瘤邊緣的最佳參數(shù)。
圖 2 (A, B) 基于熵(S)的感興趣區(qū)域(ROI)的分析結(jié)果。每個 150×150 ?m2 的 ROI(A, B)都按照圖例進行了顏色編碼,以表示 CT26 的癌變區(qū)域(A)和 4T1 的癌變區(qū)域(B),及其中檢索到的熵值。(C, D) 將 ROI 分析結(jié)果反投影到 CT26 (C)和 4T1 (D) 腫瘤模型的原圖像平面,并分割出癌變部分的圖像。紅色虛線表示腫瘤和正常組織的邊界。
責(zé)任編輯:pj
-
激光器
+關(guān)注
關(guān)注
17文章
2701瀏覽量
62182 -
顯微鏡
+關(guān)注
關(guān)注
0文章
616瀏覽量
24134 -
微透鏡
+關(guān)注
關(guān)注
1文章
24瀏覽量
9250
發(fā)布評論請先 登錄
VirtualLab Fusion應(yīng)用:具有高數(shù)值孔徑的反射顯微鏡系統(tǒng)
什么是透射電子顯微鏡?
VirtualLab Fusion應(yīng)用:用于高NA顯微鏡成像的工程化PSF
VirutualLab Fusion應(yīng)用:結(jié)構(gòu)光照明的顯微鏡系統(tǒng)
?超景深3D檢測顯微鏡技術(shù)解析
VirtualLab Fusion案例:單分子顯微鏡高NA成像系統(tǒng)的建模
VirtualLab Fusion案例:高NA反射顯微鏡系統(tǒng)
VirtualLab Fusion應(yīng)用:具有高數(shù)值孔徑的反射顯微鏡系統(tǒng)
共聚焦激光顯微鏡對比超分辨顯微鏡
共聚焦激光顯微鏡的使用注意事項
德國進口蔡司體視顯微鏡的使用方法

雙光子顯微成像激光調(diào)制解決方案





 SHG 圖像可以通過傳統(tǒng)的雙光子激發(fā)熒光顯微鏡(TPM)獲得?
SHG 圖像可以通過傳統(tǒng)的雙光子激發(fā)熒光顯微鏡(TPM)獲得?












評論