將小分子、核酸、蛋白質和藥物導入細胞是監測和了解細胞行為以及生物功能的重要途徑。然而,質膜是阻止外源分子進入細胞的生物屏障。因此,如何在保持細胞活力的同時高效地將外源分子遞送到細胞中是細胞生物學領域的一個重要課題。為了克服現有大規模細胞內遞送方法的弱點,例如細胞活性和遞送效率不一致,主要基于膜破壞介導機制的微技術已成為一種有前景的解決方案。然而,利用化學質膜穿孔進行單細胞遞送的方法尚未得到廣泛研究。
據麥姆斯咨詢報道,近期,清華大學化學系林金明教授團隊在ACS Applied Materials & Interfaces期刊上在線發表了題為“Chemical Plasma Membrane Perforation Generated by a Microfluidic Probe for Single-Cell Intracellular Protein Delivery”的論文。該研究使用微流控探針將含有毛地黃皂苷和目標遞送物的溶液精確地作用到單細胞上。毛地黃皂苷與質膜中的膽固醇結合誘導質膜穿孔,目標遞送物通過孔進入細胞。碘化丙啶(0.67 kDa)和FITC-葡聚糖(10、40和150 kDa)可以在3分鐘內成功引入單細胞,同時保持細胞活力。兩種蛋白質(細胞色素C和親環素A)被遞送進入細胞,并觀察到它們在細胞中的生理功能。
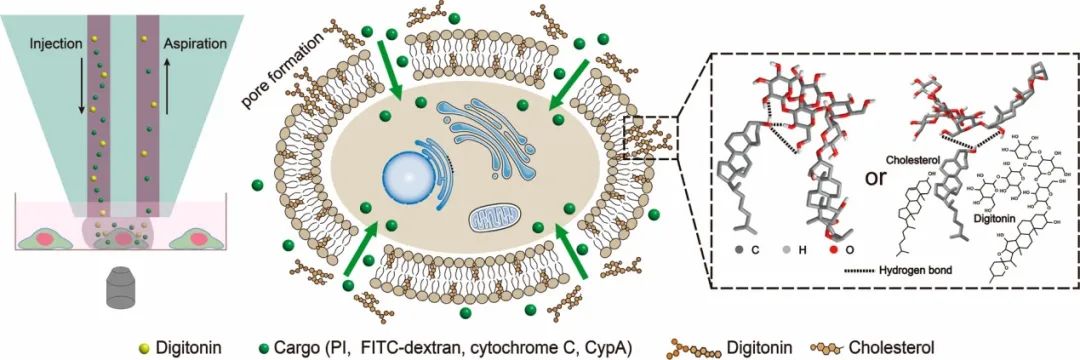
圖1 微流控探針誘導單細胞化學質膜穿孔
隨后,研究人員利用Comsol Multiphysics軟件對微流控探針形成的微區域進行數值模擬。使用熒光素(擴散系數=500 μm2/s)來指示溶質擴散。結果表明,注入的溶液可以被完全吸出,并且溶質被限制在液滴狀微區域內而不會擴散,且微區域內溶質濃度分布均勻。研究人員計算了基質上的剪切應力,結果表明,基質上的低剪切應力不會對細胞造成額外的機械損傷。實驗在與模擬相同的條件下進行,使用熒光素顯示微流控探針產生的微區域,其濃度分布與模擬結果一致。溶液的連續流動使微區域中毛地黃皂苷和目標遞送物的濃度幾乎恒定,有利于維持遞送過程的連續性和穩定性。
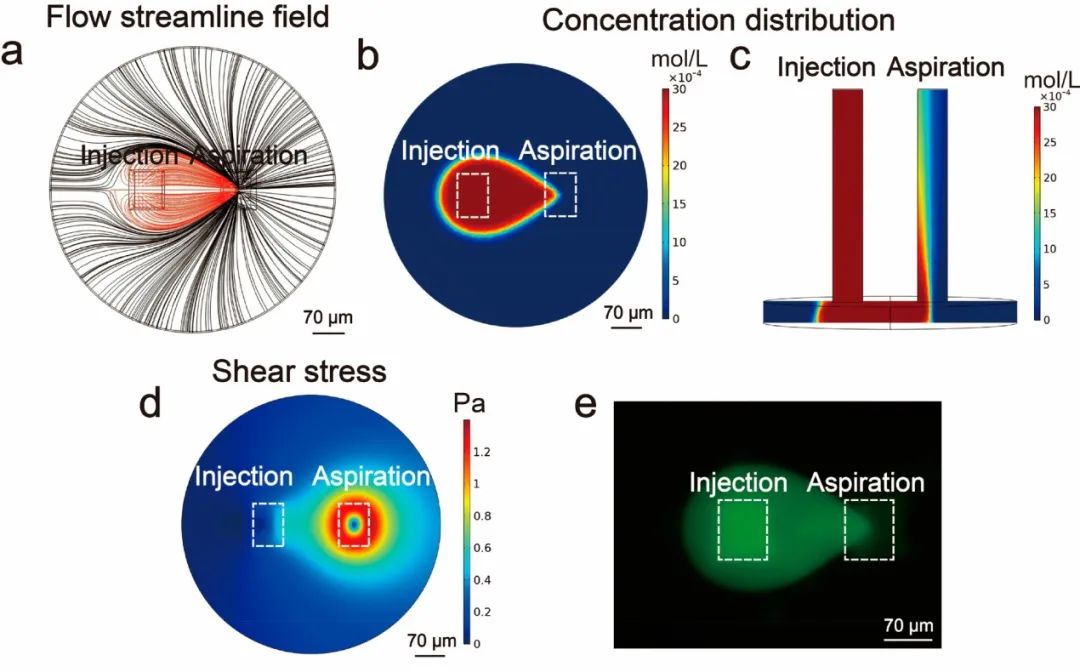
圖2 流體的數值模擬
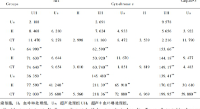
接著,研究人員通過微流控探針進行碘化丙啶(PI)的細胞內遞送來驗證該方法的可行性以及優化遞送條件。研究人員嘗試使用20 - 100 μg/mL毛地黃皂苷將PI遞送至U87細胞。隨著毛地黃皂苷濃度的增加,ts(PI開始進入時間)和tm(PI進入速度最大時間)逐漸減少,表明細胞穿孔加速。當毛地黃皂苷濃度為60 μg/mL時,ts約為20 s,1 min內即可觀察到清晰的熒光。此外,還嘗試了不同的PI濃度進行細胞內遞送,較高的PI濃度也使得PI能夠更快地進入細胞。還測試了流速對遞送結果的影響。注入流量保持2 μL/min,抽出流量在6~14 μL/min之間調整。當抽吸流速大于8 μL/min時,進入細胞的PI量隨著流速的增長而顯著增加。
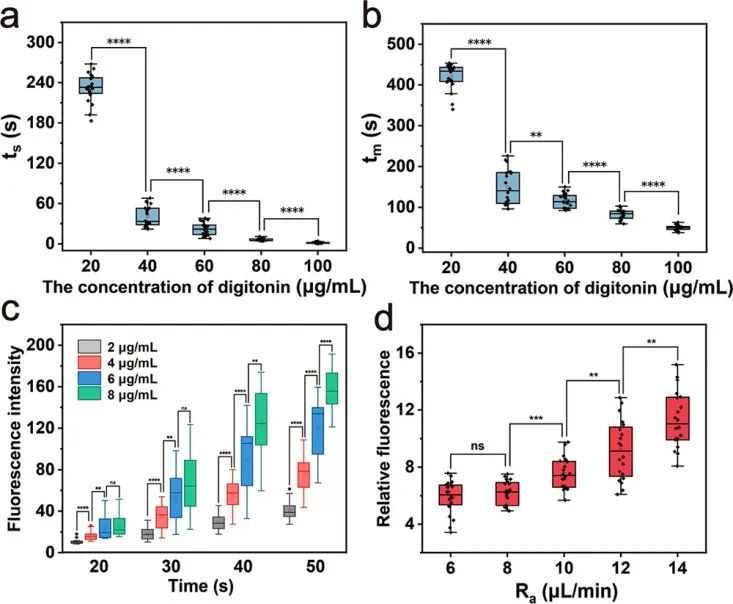
圖3 毛地黃皂苷濃度、PI濃度和流速對細胞內遞送的影響
為了證明該方法的效率和通用性,使用該方法將PI遞送至U87、HUVEC和A549細胞。當遞送時間為20秒時,三種類型的細胞幾乎不發出熒光。隨著遞送時間逐漸增加,細胞的相對熒光強度顯著增加,遞送處理50 s后觀察到強烈的紅色熒光。由于洋地黃皂苷的作用,質膜逐漸透化,PI通過質膜上形成的孔繼續進入細胞。接著,研究人員繼續研究了該方法遞送大分子的能力。使用不同分子量(10、40和150 kDa)的 FITC-葡聚糖作為目標遞送物,結果顯示,FITC-葡聚糖可以在3 min內進入細胞,并且FITC-葡聚糖進入的量隨著遞送時間的增加而增加。
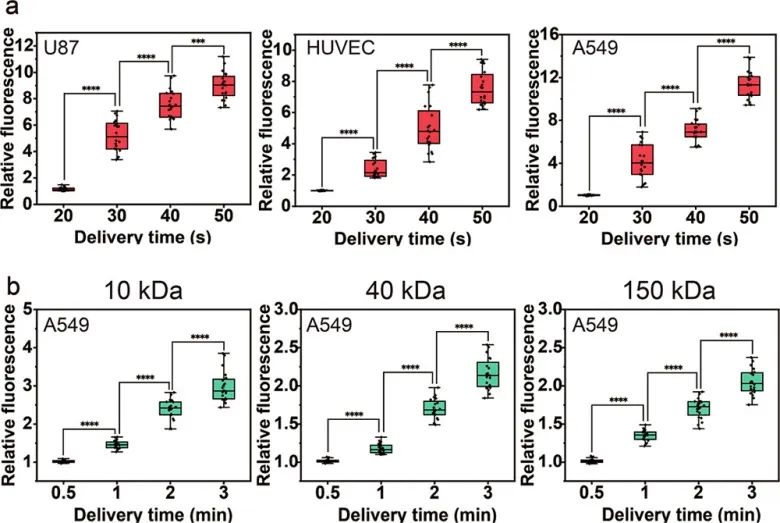
圖4 PI和FITC-葡聚糖遞送的結果
在驗證了這種方法用于單細胞胞內遞送的可行性后,研究人員嘗試了細胞內蛋白質遞送。細胞色素C(Cyt C)(Mw = 13 kDa)是線粒體中的一種蛋白質,可將電子轉移到呼吸鏈以維持ATP的產生。當Cyt C釋放到細胞質中時,它會引發細胞凋亡。由于外源Cyt C在正常情況下不能進入細胞,利用微流控探針將Cyt C遞送至A549中作為抗腫瘤藥物以誘導細胞凋亡。對照組和僅用毛地黃皂苷或Cyt C處理的細胞之間未觀察到caspase-3水平和Hoechst 33342染色結果的顯著差異。毛地黃皂苷誘導的質膜穿孔不會引起細胞凋亡。僅用Cyt C處理的細胞中caspase-3的水平也沒有增加,表明正常情況下Cyt C不能穿過質膜進入細胞激活凋亡途徑。然而,在進行毛地黃皂苷介導的Cyt C遞送的細胞中,caspase-3水平顯著增加,藍色熒光顯著增強。細胞形態發生明顯變化,細胞體積縮小,并形成凋亡小體。這些結果表明,遞送的Cyt C成功誘導細胞凋亡,并且外源蛋白可以通過微流控探針有效地引入細胞內并發揮作用。
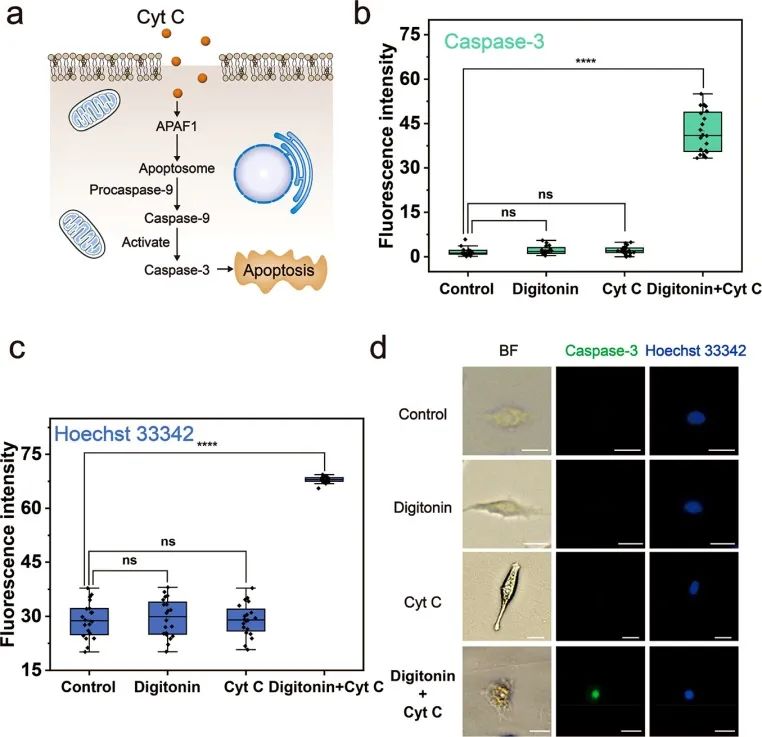
圖5 Cyt C被遞送至A549以誘導細胞凋亡
為了進一步探索這種方法在細胞研究中的潛力,研究人員利用它來研究腫瘤耐藥性。CypA(Mw = 18 kDa)是一種廣泛存在的細胞內蛋白質,可充當抗氧化劑。最近有報道稱CypA通過重塑細胞氧化狀態可以介導結直腸癌耐藥。BCNU是一種常用的抗腫瘤藥物,其誘導細胞毒性的機制之一是谷胱甘肽還原酶的抑制導致ROS的積累。利用微流控探針將CypA遞送到U87中,研究CypA對膠質瘤耐藥性的影響。與對照組相比,未經CypA遞送的細胞經BCNU處理1小時后ROS水平顯著升高,并且細胞形態發生改變。對于遞送CypA的細胞,ROS含量顯著低于未遞送細胞,并且細胞保持正常形態。結果表明,遞送的CypA在細胞中具有抗氧化作用,這可能增強U87對BCNU的耐藥性。抑制CypA表達可能是治療神經膠質瘤的潛在方法。
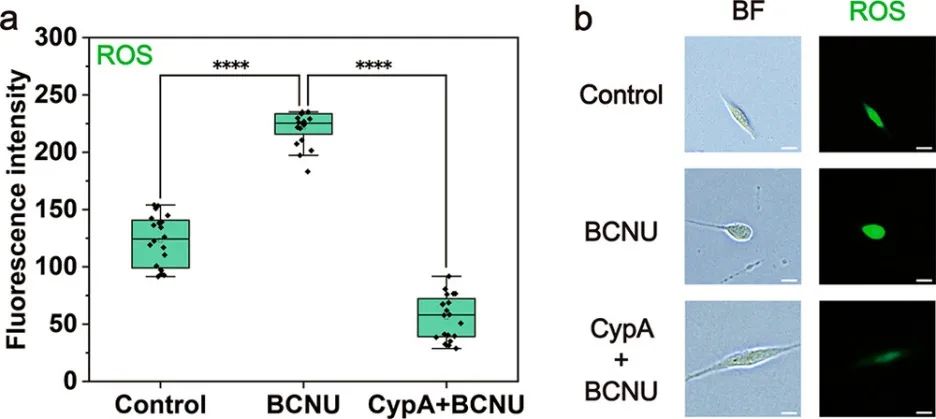
圖6 CypA對膠質瘤耐藥性的影響
綜上所述,研究人員開發了一種基于開放式微流控探針的方法,以方便高效地實現單細胞遞送。該方法通過使用化學試劑對單個細胞進行質膜穿孔,將最大分子量為150 kDa的外源目標遞送物遞送到細胞中。與載體介導或場輔助遞送方法相比,該方法不需要對目標遞送物進行額外處理,無需物理場輔助的溫和遞送條件也避免了對目標遞送物和細胞的額外損傷。此外,研究人員展示了使用微流控探針進行Cyt C和CypA的細胞內遞送,證明了該方法能夠研究外源蛋白質對細胞生命活動的影響。未來,各種目標遞送物(肽、蛋白質、mRNA、DNA、質粒、細胞器等)可以通過這種方法導入細胞內,調節細胞的生理功能和命運。而且該方法不需要昂貴的設備,操作簡單,有望成為單細胞遞送的一種理想方法。 清華大學化學系林金明教授為該論文的通訊作者,清華大學化學系2022級博士生宋揚為本論文的第一作者。該研究受到國家重點研發計劃(No.2022YFC3400700)和國家自然科學基金(No.22034005)的支持。
論文鏈接:
https://pubs.acs.org/doi/10.1021/acsami.4c03013
審核編輯:劉清
-
探針
+關注
關注
4文章
219瀏覽量
20904 -
微流控
+關注
關注
16文章
578瀏覽量
19772
原文標題:利用微流控探針誘導的化學質膜穿孔,實現單細胞胞內蛋白質遞送
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
安泰功率放大器在微流控納米藥物遞送系統中的應用分享

太赫茲細胞能量儀主控芯片方案單片機開發控制板布局規劃
華為依托昇騰AI打造蛋白結構預測工具
2025-2030年微流控行業發展趨勢預測
微流控芯片在細胞培養檢測中的應用
功率放大器應用分享:利用微流控技術促進干細胞心肌組織成熟
AI實火!諾貝爾又把化學獎頒給AI大模型
差示掃描量熱儀測試蛋白質的應用案例

創客中國AIGC專題賽冠軍天鶩科技:AI蛋白質設計引領者

EvolutionaryScale推出基于NVIDIA GPU模型的新型蛋白質研究方案
高頻功率放大器模塊在聲化學誘導艾氏腹水瘤細胞研究的應用





 利用微流控探針誘導的化學質膜穿孔,實現單細胞胞內蛋白質遞送
利用微流控探針誘導的化學質膜穿孔,實現單細胞胞內蛋白質遞送










評論