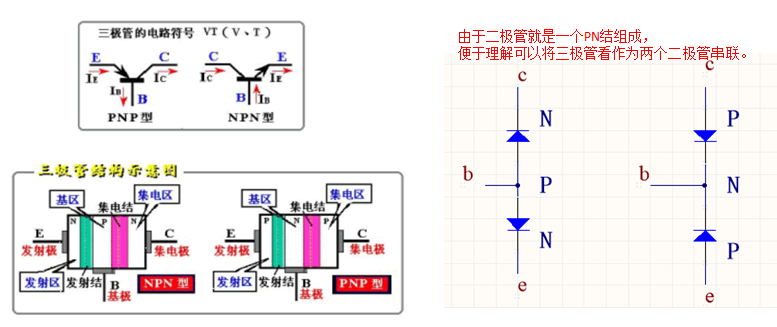
三電極體系組成
相應(yīng)的三個(gè)電極為工作電極、參比電極和輔助電極。
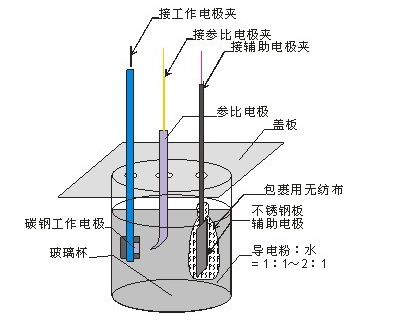
工作電極:又稱(chēng)研究電極,是指所研究的反應(yīng)在該電極上發(fā)生。一般來(lái)講,對(duì)工作電極的基本要求是:工作電極可以是固體,也可以是液體,各式各樣的能導(dǎo)電的固體材料均能用作電極。(1)所研究的電化學(xué)反應(yīng)不會(huì)因電極自身所發(fā)生的反應(yīng)而受到影響,并且能夠在較大的電位區(qū)域中進(jìn)行測(cè)定;(2)電極必須不與溶劑或電解液組分發(fā)生反應(yīng);(3)電極面積不宜太大,電極表面最好應(yīng)是均一平滑的,且能夠通過(guò)簡(jiǎn)單的方法進(jìn)行表面凈化等等。
工作電極的選擇:通常根據(jù)研究的性質(zhì)來(lái)預(yù)先確定電極材料,但最普通的“惰性”固體電極材料是玻碳(鉑、金、銀、鉛和導(dǎo)電玻璃)等。采用固體電極時(shí),為了保證實(shí)驗(yàn)的重現(xiàn)性,必須注意建立合適的電極預(yù)處理步驟,以保證氧化還原、表面形貌和不存在吸附雜質(zhì)的可重現(xiàn)狀態(tài)。在液體電極中,汞和汞齊是最常用的工作電極,它們都是液體,都有可重現(xiàn)的均相表面,制備和保持清潔都較容易,同時(shí)電極上高的氫析出超電勢(shì)提高了在負(fù)電位下的工作窗口記被廣泛用于電化學(xué)分析中。
輔助電極:又稱(chēng)對(duì)電極,輔助電極和工作電極組成回路,使工作電極上電流暢通,以保證所研究的反應(yīng)在工作電極上發(fā)生,但必須無(wú)任何方式限制電池觀測(cè)的響應(yīng)。由于工作電極發(fā)生氧化或還原反應(yīng)時(shí),輔助電極上可以安排為氣體的析出反應(yīng)或工作電極反應(yīng)的逆反應(yīng),以使電解液組分不變,即輔助電極的性能一般不顯著影響研究電極上的反應(yīng)。但減少輔助電極上的反應(yīng)對(duì)工作電極干擾的最好辦法可能是用燒結(jié)玻璃、多孔陶瓷或離子交換膜等來(lái)隔離兩電極區(qū)的溶液。
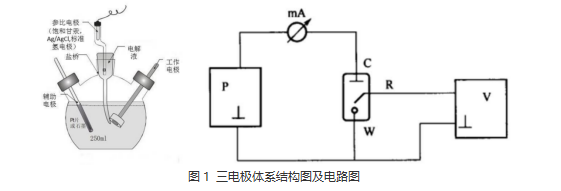
三電極體系結(jié)構(gòu)及電路圖
電化學(xué)測(cè)試的方法很多,根據(jù)測(cè)試的特質(zhì),可以分為以下幾大類(lèi):1.穩(wěn)態(tài)測(cè)試方法;2.暫態(tài)測(cè)試方法;3.伏安法;4.交流阻抗法等。這里小編只給大家簡(jiǎn)單介紹一些使用最普遍,功能最強(qiáng)大的電化學(xué)測(cè)試方法。在此之前,先對(duì)電化學(xué)測(cè)試最常用的三電極測(cè)試體系進(jìn)行簡(jiǎn)單介紹。
所謂的三電極體系,是為了排除電極電勢(shì)因極化電流而產(chǎn)生的較大誤差而設(shè)計(jì)的。它在普通的兩電極體系(工作電極與對(duì)電極)的基礎(chǔ)上引入了用以穩(wěn)定工作電極的參比電極,如圖2示。如左圖,電解池由三個(gè)電極組成:工作電極(W),對(duì)電極(C)以及參比電極(R)。
W是主要的電極研究和操作對(duì)象,R是電勢(shì)電極的比較標(biāo)準(zhǔn),而C主要用以通過(guò)極化電流,實(shí)現(xiàn)對(duì)電極的極化。右圖中,我們可以看到,三電極體系在電路中時(shí),P代表極化電源,為研究電極提供極化電流。mA和V分別為電流表和電壓表,用以測(cè)試電流和電勢(shì)。P,mA,C,W構(gòu)成的左側(cè)回路,稱(chēng)為極化回路,在極化回路中有極化電流通過(guò),可對(duì)參比電極進(jìn)行測(cè)量和控制。V,R,W構(gòu)成了右側(cè)回路,稱(chēng)為測(cè)量控制回路。在此回路中,對(duì)研究電極的電勢(shì)進(jìn)行測(cè)量和控制,由于回路中無(wú)極化電流流過(guò),僅有極小的測(cè)量電流,所以不會(huì)研究電極的極化狀態(tài)和參比電極的穩(wěn)定性造成干擾。由此可見(jiàn),三電極體系可使研究電極表面通過(guò)極化電流,又不會(huì)妨礙研究的電極電勢(shì)的控制和測(cè)量,可同時(shí)實(shí)現(xiàn)電勢(shì)和電流的控制和測(cè)量。所以,大部分電化學(xué)研究測(cè)試均在三電極體系完成。
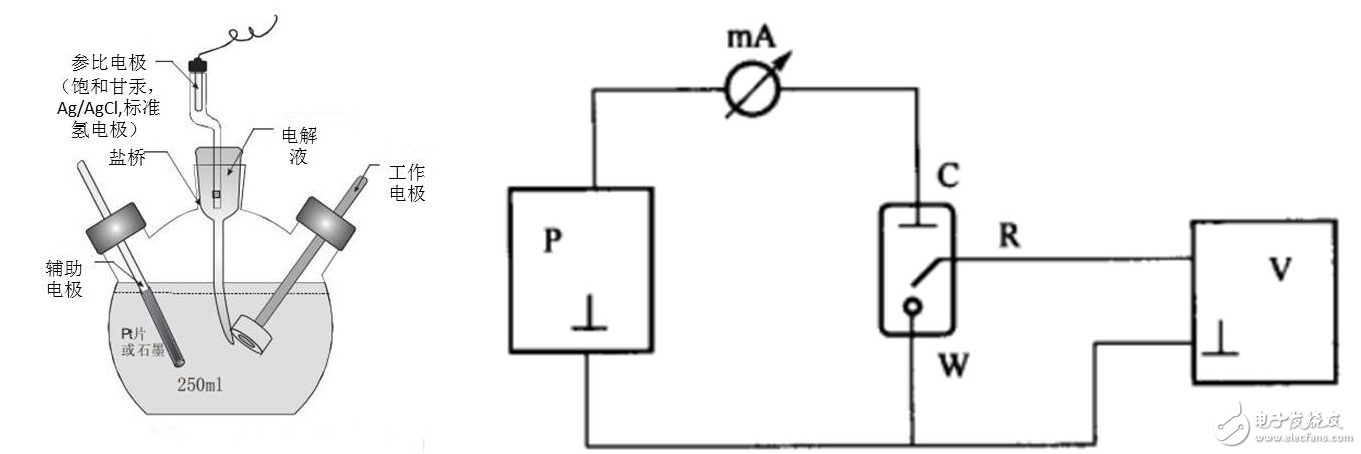
圖2 三電極體系結(jié)構(gòu)圖及電路圖
接下來(lái),小編就把最常用的幾種電化學(xué)測(cè)試手段進(jìn)行簡(jiǎn)單介紹。
1.穩(wěn)態(tài)測(cè)試:恒電流法及恒電勢(shì)法
所謂的穩(wěn)態(tài),即電化學(xué)參量(電極電勢(shì),電流密度,電極界面狀態(tài)等)變化甚微或基本不變的狀態(tài)。最常用的穩(wěn)態(tài)測(cè)試方法,當(dāng)然就是恒電流法及恒電勢(shì)法,故名思意,就是給電化學(xué)體系一個(gè)恒定不變的電流或者電極電勢(shì)的條件。通常我們可以利用恒電位儀或者電化學(xué)工作站來(lái)實(shí)現(xiàn)這種條件。通過(guò)在電化學(xué)工作站簡(jiǎn)單地設(shè)置電流或電勢(shì)以及時(shí)間這幾個(gè)參數(shù),就可以有效地使用這兩種方法啦。該方法用的比較多的地方主要有:活性材料的電化學(xué)沉積以及金屬穩(wěn)態(tài)極化曲線的測(cè)定(如圖3)等等。
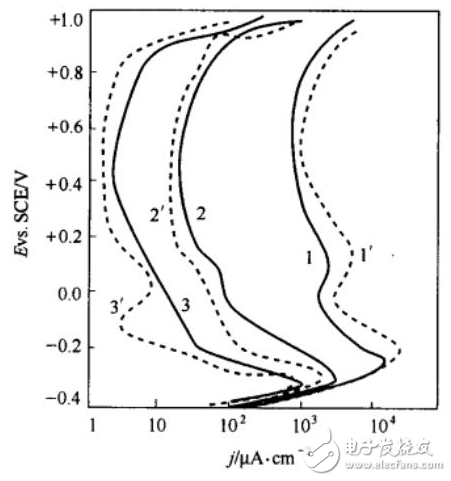
圖3 ?不同掃速下金屬的穩(wěn)態(tài)極化曲線
2.暫態(tài)測(cè)試:控制電流階躍及控制電勢(shì)階躍法
所謂的暫態(tài),當(dāng)然是相對(duì)于穩(wěn)態(tài)而言的。在一個(gè)穩(wěn)態(tài)向另一個(gè)穩(wěn)態(tài)的轉(zhuǎn)變過(guò)程中,任意一個(gè)電極還未達(dá)到穩(wěn)態(tài)時(shí),都處于暫態(tài)過(guò)程,如雙電層充電過(guò)程,電化學(xué)反應(yīng)過(guò)程以及擴(kuò)散傳質(zhì)過(guò)程等。最常見(jiàn)的方法要數(shù)控制電流階躍法以及控制電勢(shì)階躍法這兩種。控制電流階躍法,也叫計(jì)時(shí)電位法,即在某一時(shí)間點(diǎn),電流發(fā)生突變,而在其他時(shí)間段,電流保持相應(yīng)的恒定狀態(tài)。
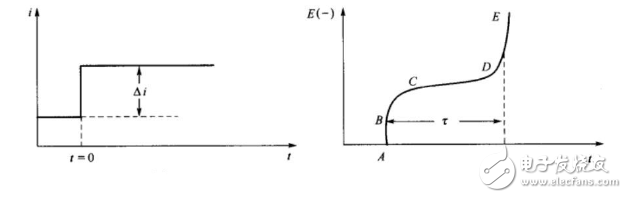
圖4 ?計(jì)時(shí)電位法電流階躍(左圖)及相應(yīng)的電勢(shì)變化(右圖)。
同理,控制電勢(shì)階躍法也就是計(jì)時(shí)電流法,即在某一時(shí)間點(diǎn),電勢(shì)發(fā)生突變,而在其他時(shí)間段,電勢(shì)保持相應(yīng)的恒定狀態(tài)。
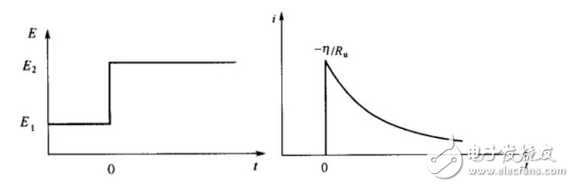
圖5 ?計(jì)時(shí)電位法電勢(shì)階躍(左圖)及相應(yīng)的電流變化(右圖)。
利用這種暫態(tài)的控制方法,一般可以探究一些電化學(xué)變化過(guò)程的性質(zhì),如能源存儲(chǔ)設(shè)備充電過(guò)程的快慢,界面的吸附或擴(kuò)散作用的判斷等。計(jì)時(shí)電流法還可以用以探究電致變色材料變色性能的優(yōu)劣。
3.伏安法:線性伏安法,循環(huán)伏安法
伏安法應(yīng)該算是電化學(xué)測(cè)試中最為常用的方法,因?yàn)殡娏鳌㈦妷壕3謩?dòng)態(tài)的過(guò)程,才是最常見(jiàn)的電化學(xué)反應(yīng)過(guò)程。一般而言,伏安法主要有線性伏安法以及循環(huán)伏安法,兩者的區(qū)別在于,線性伏安法“有去無(wú)回”,而循環(huán)伏安法“從哪里出發(fā)就回哪去”。線性伏安法即在一定的電壓變化速率下,觀察電流相應(yīng)的響應(yīng)狀態(tài)。同理,循環(huán)伏安法也是一樣,只不過(guò)電壓的變化是循環(huán)的,從起點(diǎn)到終點(diǎn)再回到起點(diǎn)。
線性伏安法使用的領(lǐng)域較廣,主要包括太陽(yáng)能電池光電性能的測(cè)試,燃料電池等氧還原曲線的測(cè)試以及電催化中催化曲線的測(cè)試等。而循環(huán)伏安法,主要用以探究超級(jí)電容器的儲(chǔ)能大小及電容行為、材料的氧化還原特性等等。
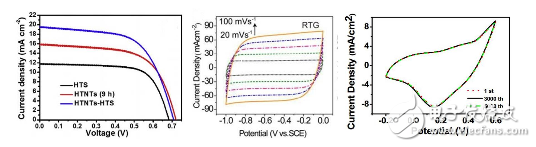
圖6伏安法電化學(xué)測(cè)試:左圖為線性伏安測(cè)試太陽(yáng)能電池的開(kāi)路電壓及短路電流;中間為循環(huán)伏安法測(cè)試電容行為較強(qiáng)的碳材料;右圖為含有氧化還原行為的電極材料的循環(huán)伏安測(cè)試
4.交流阻抗法
交流阻抗法的主要實(shí)現(xiàn)方法是,控制電化學(xué)系統(tǒng)的電流在小幅度的條件下隨時(shí)間變化,同時(shí)測(cè)量電勢(shì)隨時(shí)間的變化獲取阻抗或?qū)Ъ{的性能,進(jìn)而進(jìn)行電化學(xué)系統(tǒng)的反應(yīng)機(jī)理分析及計(jì)算系統(tǒng)的相關(guān)參數(shù)等。交流阻抗譜可以分為電化學(xué)阻抗譜(EIS)和交流伏安法。EIS探究的是某一極化狀態(tài)下,不同頻率下的電化學(xué)阻抗性能;而交流伏安法是在某一特定頻率下,研究交流電流的振幅和相位隨時(shí)間的變化。
這里我們重點(diǎn)介紹一下EIS。由于采用小幅度的正弦電勢(shì)信號(hào)對(duì)系統(tǒng)進(jìn)行微擾,電極上交替出現(xiàn)陽(yáng)極和陰極過(guò)程,二者作用相反,因此,即使擾動(dòng)信號(hào)長(zhǎng)時(shí)間作用于電極,也不會(huì)導(dǎo)致極化現(xiàn)象的積累性發(fā)展和電極表面狀態(tài)的積累性變化。因此EIS是一種“準(zhǔn)穩(wěn)態(tài)方法”。通過(guò)EIS,我們一般可以分析出一些表面吸附作用以及離子擴(kuò)散作用的貢獻(xiàn)分配,電化學(xué)系統(tǒng)的阻抗大小、頻譜特性以及電荷電子傳輸?shù)哪芰?qiáng)弱等等。
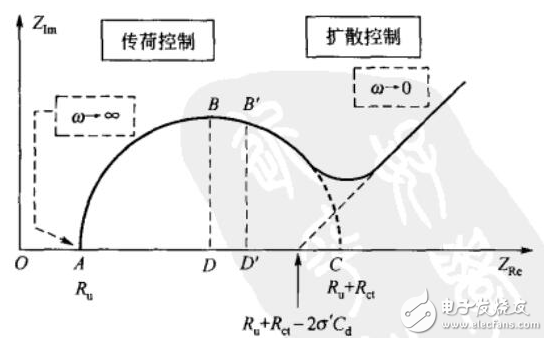
圖7 ?EIS中Nyquist圖譜
 電子發(fā)燒友App
電子發(fā)燒友App





















評(píng)論